NEWS
Die Deutsche Gesellschaft zur Bekämpfung von Fettstoffwechselstörungen und ihren Folgeerkrankungen DGFF (Lipid–Liga) e. V. besteht seit mehr als 35 Jahren und hat aktuell rd. 1.600 Mitglieder. Die fachärztliche Gesellschaft ist ein unabhängiger Ansprechpartner für Fragestellungen rund um den Fettstoffwechsel und die Atherosklerose. Ihre Aufgabe sieht die DGFF (Lipid–Liga) in der Aufklärung durch Umsetzung und Vermittlung gesicherter Erkenntnisse auf dem Gebiet der Prävention, Diagnostik und Therapie.
Hier halten wir für Sie zahlreiche News, Pressemitteilungen und mehr zur stets aktuellen Information bereit.

„LipidSnapshot“-Registerstudie zeigt: LDL-C-Senkung und -Zielwerterreichung bei ASCVD-Patient*innen ist völlig unzureichend
Mehr lesen
2nd Cholesterol Round Table at the annual meeting of the German Cardiac Society in Mannheim/Germany on April 3, 2024
Mehr lesen
First Cholesterol Round Table at the annual meeting of the German Cardiac Society in Bonn/Germany on November 7, 2023
Mehr lesen
Früherkennung und Behandlung von Herz-Kreislauf-Erkrankungen: BMG startet konzertierte Aktion – ENDLICH!
Mehr lesen
Multi-Firmen-Symposium der DGFF (Lipid-Liga) bei den DGK Herztagen 2023 Freitag, 06. Oktober 2023
Mehr lesen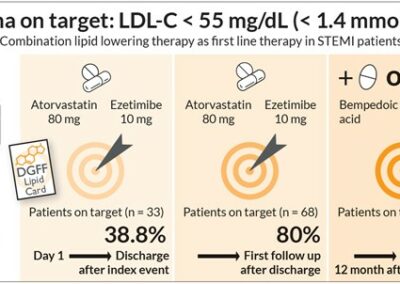
Gemeinsam bringen wir „Deutschland auf Ziel“ – 2023 zündet die DGFF (Lipid-Liga) die nächste Stufe ihrer Initiative und startet eine randomisierte prospektive Multi-Center-Studie „Deutschland auf Ziel“
Mehr lesen
Förderpreis der Gerrit Meyer & Eka Meyer-Lausch-Stiftung für ein herausragendes Projekt zur kardiovaskulären Prävention
Mehr lesen
Aktion zum Weltherztag 2022: Herzinfarkt unter 50? Blutfette beachten und Lipoprotein(a)-Wert bestimmen!
Mehr lesen
Ein Panel aus national und international führenden Expert*innen diskutiert über den aktuellen Stand der Lp(a)-Forschung
Mehr lesen
Neu erschienen: Pädiatrische Fettstoffwechselstörungen und Atheroskleroserisiko – kompakt
Mehr lesen